Condilomi genitali maschili e femminili
SALERNO
Condilomi e altri sinonimi per indicare le cosiddette creste di gallo
creste di gallo, verruche genitali, condilomi acuminati, porri venerei, papillomi anogenitali
Varianti cliniche di condilomi anogenitali
condilomi acuminati, condilomi floridi, condilomi piatti
- Condilomi: definizione della malattia
- I condilomi noti anche con il nome di verruche genitali o creste di gallo, sono malattie virali, che possono essere trasmesse con diverse modalità, compresi i rapporti sessuali e per questo rientrano nelle cosiddette malattie veneree. Nell’uomo e nella donna, i condilomi sono causati da una famiglia di virus denominati papillomavirus umani (HPV = human papillomavirus). Il virus che causa i condilomi (creste di gallo) appartiene alla stessa famiglia di virus delle verruche comuni (cosiddetti porri) e non necessariamente viene trasmesso con i rapporti sessuali. Infatti gli americani utilizzano raramente il termine condiloma, preferendo invece termini come skin warts (verruche cutanee) per indicare le comuni verruche e genital warts (verruche genitali) per indicare i condilomi. Una volta presenti ai genitali, i condilomi possono essere trasmessi con i rapporti sessuali e per questo motivo devono essere curati. I papillomavirus umani hanno uno spiccato tropismo per gli epiteli di rivestimento e in base al loro genotipo possono attaccare prevalentemente la cute (es. pube, pene, scroto, grandi labbra, vulva, perineo, regione perianale, distretti extragenitali) o le mucose (es. vagina, cervice uterina, uretra, lingua, cavo orale, laringe, cavità nasale, esofago, congiuntiva, etc). Data la frequente associazione di alcuni genotipi di HPV cosiddetti ad alto rischio (es. HPV 16, HPV 18, etc) con il carcinoma della cervice uterina, se si ha il sospetto di aver contratto dei condilomi dal partner è importante sottoporsi a una visita medica. Se i condilomi si sono verificati in seguito a un rapporto occasionale con una persona non nota, andrebbe programmato con il proprio dermatologo, un checkup mirato ad escludere possibili malattie veneree associate. Come per le altre malattie veneree (es. sifilide, gonorrea, ulcera molle, linfogranuloma venereo, granuloma inguinale, herpes genitale, infezioni da clamidia, infezioni da micoplasma, infezioni da ureaplasma, infezione da HIV, epatite B, epatite C, infezione da trichomonas vaginalis, etc) molto importanti sono l’approccio e la preziosa collaborazione multidisciplinare Dermatologo e Ginecologo nella diagnosi ed eventuale terapia della coppia.
Condilomi: sintomi
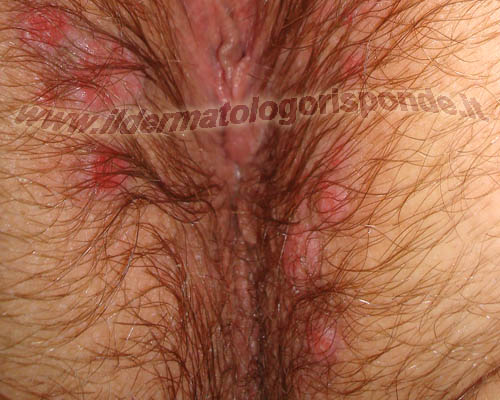
I condilomi si presentano sotto forma di escrescenze carnose di consistenza più o meno dura e di colorito variabile dal rosa al brunastro. Durante la gravidanza i condilomi possono aumentare sia come numero che come dimensioni. I condilomi si possono presentare in qualsiasi distretto ano genitale (per esempio prepuzio, glande, uretra, scroto, asta, ano, perineo, vagina, vulva, etc) e i genotipi ad alto rischio hanno uno spiccato tropismo per la cervice uterina. Al momento della visita dermatologica, i condilomi devono essere distinti da manifestazioni benigne come le cheratosi seborroiche, i fibromi penduli, i nei, gli angiocheratomi di Fordyce, i grani di Fordyce e le papule perlacee. I condilomi devono anche essere distinti da altre malattie infettive dei genitali come il mollusco contagioso (infezione da poxvirus), la papulosi bowenoide e i condilomi piani della sifilide secondaria (infezione da treponema pallidum).
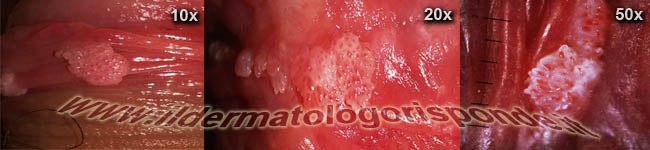
Immagini di condilomi osservati mediante penoscopia con tipico pattern vascolare punteggiato visibile nei diversi ingrandimenti
La genitoscopia (es. penoscopia, vulvoscopia, etc) può essere effettuata al momento della visita dermatologica per distinguere i condilomi (pattern vascolare punteggiato) da eventuali altre manifestazioni fisiologiche, come le papule perlacee (pattern vascolare a forcina di capelli). I condilomi piatti da papillomavirus, sono manifestazioni completamente diverse dai condilomi piani della sifilide secondaria (placche mucose) e pertanto richiedono una terapia e un follow up completamente diverso.
Condilomi acuminati: le cause
I Papillomavirus sono piccoli virus del diametro di 55 nm, con un DNA circolare di una lunghezza variabile tra 7800 e 8200 coppie di basi, a seconda del genotipo. Nelle manifestazioni cliniche benigne, il DNA virale non si integra nel genoma della cellula, contrariamente a quanto avviene nelle manifestazioni neoplastiche (es. carcinoma del collo dell’utero). Attualmente si conoscono oltre 220 tipi di HPV e i cui genotipi sono stati già sequenziati. Esistono dei ceppi di HPV epidermotropi a prevalente tropismo cutaneo (per esempio HPV 1 delle verruche plantari), ceppi di HPV a prevalente colonizzazione mucosa (es. cavo orale, gola, mucose anogenitali, etc) e ceppi di HPV a tropismo misto cutaneo mucoso (es. HPV 2, HPV 3, HPV 7, HPV 10, etc). La famiglia dei papillomavirus comprende 16 generi diversi, contrassegnati con le lettere dell’alfabeto greco, dall’alpha alla zeta. Gli Alpha papillomavirus hanno un maggiore tropismo per le mucose, mentre i Beta papillomavirus sono prevalentemente cutanei. Ogni genere di papillomavirus contiene più specie, contrassegnate dai numeri romani. A sua volta, ogni specie di papillomavirus contiene più genotipi. I papillomavirus con genotipo HPV 16 e HPV 31 ad esempio, appartengono entrambi alla specie n.9 del genere alpha papillomavirus. I papillomavirus riescono molto spesso a eludere le difese immunitarie, in quanto non creano lisi cellulare e non innescano fenomeni infiammatori particolarmente allarmanti per le difese dell’ospite. Il profilattico riduce notevolmente il rischio di infezione ma non lo elimina del tutto, in quanto i condilomi possono essere presenti anche nelle aree non protette (es. pube, regione perianale, etc).
Prevenzione dei condilomi e delle malattie veneree in genere
I rapporti sessuali occasionali con persone sconosciute, dovrebbero essere possibilmente protetti per tutta la durata del rapporto, fin dalle fasi preliminari. Il periodo di incubazione del virus può essere a volte anche di alcuni mesi e ciò rende difficile poter risalire al partner a rischio, in caso di rapporti promiscui. È importante informare sempre il partner della patologia, per una visita medica ed eventuale screening di coppia per escludere eventuali altre malattie veneree, a volte associate ai condilomi (AIDS incluso). Come per le verruche comuni, anche il trattamento dei condilomi richiede molta pazienza in quanto necessita a volte di diversi controlli medici e solo nei casi più fortunati può essere sempre completato in una sola seduta.
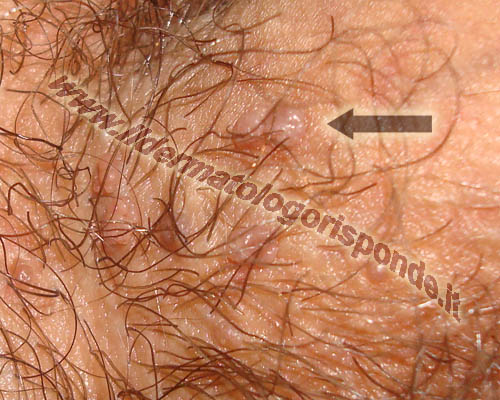
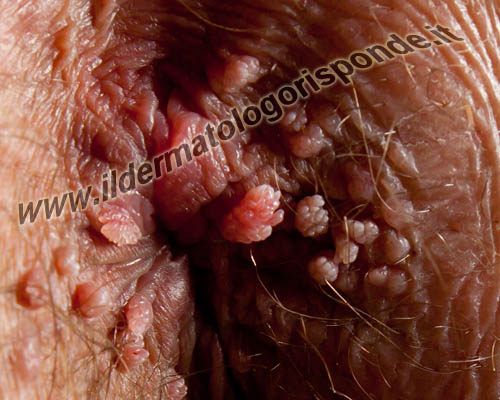
Condilomi acuminati localizzati alla base del pene (foto in alto) e condilomi perianali (foto in basso)
Terapia dei condilomi acuminati
Le terapie attualmente disponibili comprendono diverse metodiche che il medico può utilizzare in base alle manifestazioni cliniche e alle condizioni del paziente. La crioterapia con azoto liquido è una metodica molto utilizzata per il trattamento dei condilomi anogenitali sia maschili che femminili. Essa richiede solo qualche minuto e si basa sull’erogazione di azoto a temperatura molto bassa, sotto forma di uno spray, in maniera del tutto analoga al trattamento delle verruche comuni che colpiscono le aree extra genitali. La crioterapia dei condilomi esterni di piccole dimensioni, nella maggior parte dei casi è ben tollerata e tranne in casi selezionati, richiede raramente una preparazione con anestesia. L’imiquimod in crema al 5%, molecola agonista dei toll like receptors di tipo 7, può essere un farmaco molto valido nel trattamento dei condilomi genitali, se utilizzato sotto la guida del proprio medico. A volte può indurre una reazione irritativa transitoria, più o meno intensa, quasi sempre indice di attività e di efficacia del farmaco. Consultare sempre il medico che ha prescritto il farmaco, per stabilire come procedere. In ogni caso si tratta di veri e propri farmaci, ottimi sotto la guida del medico, ma a volte rischiosi se utilizzati con il fai da te (regola che vale per tutti i farmaci in generale). La podofillotossina in crema è un’altra arma preziosa nelle mani del dermatologo e anche in questo caso (come per tutti i farmaci), andrebbe evitata l’autosomministrazione, senza aver prima consultato il proprio medico. Le varie metodiche (per esempio crioterapia con azoto liquido, imiquimod, podofillotossina, idrossido di potassio, tirbanibulin, thuja occidentalis, sinecatechine del thè verde, laser) possono talora essere combinate dal dermatologo, in un percorso terapeutico adattato al caso specifico del singolo paziente. L’imiquimod in crema ad esempio, viene utilizzato oltre che per il trattamento dei condilomi, anche per la prevenzione delle recidive. Rimedi naturali omeopatici e omotossicologici, possono talora affiancare la medicina tradizionale per favorire la scomparsa dei condilomi. Prima di effettuare una qualsiasi terapia, il medico spiega sempre possibili vantaggi e svantaggi di una determinata metodica. Non bisogna mai utilizzare i rimedi consigliati per la cura delle verruche comuni (es. cheratolitici) per il trattamento dei condilomi anogenitali.
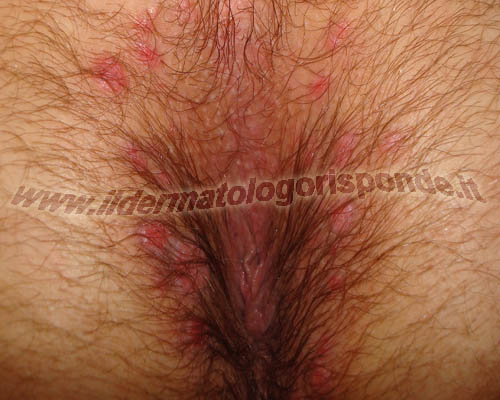
In queste due foto sono raffifurati dei condilomi piani (placche mucose) in un paziente affetto da sifilide secondaria
Cenni storici sui condilomi
Condilomi acuminati, verruche genitali e creste di gallo sono termini ampiamente utilizzati come sinonimi. Il termine condiloma fu utilizzato già nel V secolo a.C. dal medico greco Ippocrate di Kos (thumia o condiloma = gonfiore perianale). Il termine verruca fu utilizzato nel Vecchio testamento della Sacra Bibbia (Levitico) ma introdotto ufficialmente in medicina solo nel XVI secolo dal medico tedesco Daniel Sennert. Nel Regimen Sanitatis della Scuola Medica Salernitana sono riportati i primi rimedi cheratolitici a base di corteccia di salice cotta nell’aceto. Nel 1555 il medico modenese Gabriele Falloppio distingue i condilomi piani dai condilomi acuminati, almeno sul piano morfologico. Nel 1614 il chirurgo tedesco Wilhelm Fabry descrive per la prima volta i condilomi giganti del pene, con studi che saranno ampliati nel 1925 dai dermatologi tedeschi Abraham Buschke e Ludwig Löwenstein. Fino al XIX secolo i condilomi venivano interpretati come conseguenze della sifilide, della gonorrea e dell’ulcera molle. Nel 1786 infatti Evan Hunter descriveva i condilomi acuminati come sintomi della sifilide, senza distinguerli dai condilomi piani (placche mucose), tipici della sifilide secondaria (foto in alto). Nel 1842 il medico veronese Domenico Rigoni Stern, propose che fattori trasmessi sessualmente potessero essere collegati al carcinoma della cervice uterina. Dopo che Nissen nel 1879 scoprì il gonococco, si osservò che molti pazienti affetti da condilomi, non avevano sintomi di gonorrea e l’idea di una possibile associazione tra le due malattie fu completamente abbandonata. Nel 1891 il medico inglese Joseph Frank Payne propose un’eziologia simile tra le verruche comuni (skin warts) e i condilomi genitali (genital warts). Nel 1893 il dermatologo francese Louis Alphonse Gemy giunse alle stesse conclusioni, basandosi su evidenze istologiche e osservando numerosi pazienti affetti contemporaneamente da verruche comuni e genitali (condilomi). Nell’ottobre del 1906, il dermatologo cagliaritano Giuseppe Ciuffo dimostrò al IV Congresso Italiano di Patologia tenutosi a Parigi, che le verruche umane sono trasmissibili mediante materiale cutaneo ultrafiltrato (materiale proveniente da verruche e fatto passare attraverso speciali filtri in ceramica, in grado di trattenere cellule e batteri). Egli si autoinoculò un estratto di verruche volgari dimostrandone la contagiosità ed escludendo una causa batterica, in quanto si utilizzava un ultrafiltrato cell free. Egli iniziò a inoculare materiale ultrafiltrato proveniente da verruche genitali, in aree non genitali, provocando verruche comuni e a inoculare sui genitali materiale ultrafiltrato proveniente da verruche comuni, determinando la comparsa di condilomi. Nel 1907 alcuni di questi esperimenti furono pubblicati sul Giornale Italiano delle Malattie Veneree e della Pelle (Ciuffo Giuseppe. Innesto positivo con filtrato di verruca volgare. G. Ital. Mal. Venereol. 48: 12-17, 1907). Esperimenti simili sui condilomi furono condotti nel 1917 dal medico ceco Ludwig Waelsch. I papillomavirus furono descritti nei bovini intorno agli anni ’20 (bovine papillomavirus type I). Nel 1933, il virologo americano Richard Edwin Shope, dimostrò che le verruche benigne dei conigli selvatici americani dalla coda di cotone (wild cottontail rabbits, sylvilaus spp.) potevano essere trasmesse mediante materiale infetto ultrafiltrato (cell free filtrates). I conigli selvatici cottontail che circolavano nel Kansas, spesso avevano verruche sulla loro pelle. Tali studi si fecero interessanti, quando in alcuni conigli domestici (raramente nei conigli selvatici cottontail), le verruche divenivano carcinomatose. Nel 1936 fu isolato un papillomavirus dal cavo orale di un coniglio domestico (ROPV = rabbit oral papillomavirus) che se inoculato, induceva papillomi solo al cavo orale e non in altre sedi. L’ipotesi virale fu confermata solo nel 1949 quando il dermatologo americano Maurice Strauss dimostrò con il microscopio elettronico, la presenza di particelle virali (human papillomavirus) in verruche palmoplantari. La morfologia delle particelle era identica sia nelle verruche comuni che nelle verruche genitali (condilomi). Ciò portò alla formulazione della cosiddetta teoria unitaria, secondo la quale, verruche comuni e condilomi sono causate dallo stesso agente eziologico. Nel 1954 il medico americano Thomas Barrett aggiunse i condilomi alla lista delle altre malattie veneree classiche, osservando la comparsa di condilomi in un gruppo di donne, circa 1 mese dal ritorno dei rispettivi mariti marinai, affetti dalla malattia. Nel 1974 furono compiuti importanti studi dal virologo tedesco Harald zur Hausen, sull’associazione tra infezione da HPV e displasia della cervice uterina, che lo hanno condotto nel 2008 alla splendida vittoria del premio nobel per la Medicina. L’esatta sequenza del DNA del papillomavirus, fu resa nota nel 1984. Nel 1999, l’International Agency of Research on Cancer, riconosce il papillomavirus tra le cause del carcinoma della cervice uterina. L’elenco dei papillomavirus umani è in costante aggiornamento e attualmente supera i 200 sottotipi. Non tutti i ceppi di HPV sono associati alla presenza di condilomi. Alcuni ceppi di HPV sono normalmente presenti su cute sana come parte integrante del cosiddetto viroma cutaneo, cioè dell’insieme dei virus che convivono con l’uomo, analogamente ai batteri commensali che formano il microbiota cutaneo e ai miceti saprofiti che costituiscono il micoma cutaneo. Nel 2014 ad esempio è stato riscontrato su cute sana un gamma papillomavirus denominato HPV 178. Nell’attuale sistema di classificazione delle malattie (ICD-11) i condilomi anali sono classificati con il codice 1A95.0, i condilomi genitali con il codice 1A95.1 e i condilomi extragenitali con il codice 1A95.2.
Test HPV e tipizzazione genomica mediante PCR (su DNA o mRNA del papillomavirus)
Attualmente ci sono diversi tipi di test per la ricerca e la tipizzazione genomica dell’HPV (genotipizzazione del papillomavirus) che utilizzano una o più tecniche di diagnostica molecolare di nuova generazione come l’amplificazione genica della regione L1 virale mediante PCR (es. HPV DNA test) e la ricerca del mRNA virale che codifica per le proteine oncogeniche E6 ed E7 (es. mRNA HPV test o ricerca dell’RNA messaggero). Con la maggior parte dei kit di screening attualmente disponibili, vengono ricercate e amplificate specifiche regioni di acido nucleico virale, in particolare di quei genotipi di HPV associati ad alto rischio oncogeno, con tempi di risposta che possono variare a seconda del tipo di test utilizzato. Per quanto riguarda la profilassi il vaccino per il Papilloma virus è utilizzato soprattutto nei giovani per la prevenzione verso alcuni ceppi di HPV (per esempio vaccino nonavalente attivo su HPV 6, HPV 11, HPV 16, HPV 18, HPV 31, HPV 33, HPV 45, HPV 52 e HPV 58).
La grande famiglia dei papilloma virus HPV classificata in generi, specie e genotipi
In base alle caratteristiche genotipiche, i papillomavirus umani e animali sono stati suddivisi nei seguenti generi:
Alpha papillomavirus: possono interessare la cute e soprattutto le mucose. Alcuni genotipi hanno uno spiccato tropismo per la cervice uterina e sono definiti ad alto rischio.
Beta papillomavirus: interessano prevalentemente la cute. I genotipi 5, 9 e 49 si associano talora all’epidermodisplasia verruciforme. I genotipi 92 e 96 si possono associare a manifestazioni precancerose. Alcuni genotipi di HPV molto rari (es. 98, 99, 100, 104 e 113) sono stati isolati in lesioni maligne del cavo orale e dell’esofago, oltre che nella cute.
Gamma papillomavirus: interessano prevalentemente la cute degli esseri umani. Tra i più importanti gamma papillomavirus ricordiamo i genotipi HPV 4, 48, 50, 60, 153, 175, 178, 221 e 225.
Delta papillomavirus: infettano solitamente bovini, ovini, renne e alci, provocando lesioni fibropapillomatose.
Epsilon papillomavirus: il più importante è il papillomavirus bovino di tipo 5.
Eta papillomavirus: comprendono alcuni papillomavirus aviari (es. Fringilla coelebs papillomavirus).
Theta papillomavirus: comprendono alcuni papillomavirus aviari (es. Psittacus erithacus timneh papillomavirus).
Iota papillomavirus: comprendono i papillomavirus dei roditori (es. Mastomys natalensis papillomavirus).
Kappa papillomavirus: sono responsabili di manifestazioni cutanee e mucose nei conigli (es. papillomavirus di Shope del coniglio americano selvatico cottontail).
Lambda papillomavirus: sono responsabili di manifestazioni cutanee e mucose nei cani (es. Canine oral papillomavirus) e nei gatti (es. Felis domesticus papillomavirus).
Mu papillomavirus: sono responsabili delle verruche comuni e comprendono i genotipi HPV 1 e HPV 63.
Nu papillomavirus: comprendono il genotipo HPV 41, responsabile di manifestazioni cutanee benigne e maligne
Xi papillomavirus: sono responsabili di manifestazioni cutanee e mucose nei bovini (es. HPV bovino tipo 3, 4 e 6).
Omikron papillomavirus: sono stati isolati dalle verruche genitali di alcuni cetacei (es. Phocoena spinipinnis o comunemente focena spinipinne).
Pi papillomavirus: sono responsabili di manifestazioni al cavo orale nei criceti (es. hamster oral papillomavirus).
Zeta papillomavirus: il più importante è il papillomavirus equino di tipo 1.
| GENOTIPO | GENERE | TROPISMO | RISCHIO |
|---|---|---|---|
| HPV 1 | Mu papillomavirus | Cute | Verruche |
| HPV 2 | Alpha papillomavirus | Cute e Mucose | Verruche |
| HPV 3 | Alpha papillomavirus | Cute e Mucose | Basso |
| HPV 4 | Gamma papillomavirus | Cute | |
| HPV 5 | Beta papillomavirus | Cute | |
| HPV 6 | Alpha papillomavirus | Condilomi | Basso |
| HPV 7 | Alpha papillomavirus | Cute e mucose | Verruche dei macellai |
| HPV 8 | Beta papillomavirus | Cute | |
| HPV 9 | Beta papillomavirus | Cute | |
| HPV 10 | Alpha papillomavirus | Cute e Mucose | Basso |
| HPV 11 | Alpha papillomavirus | Condilomi | Basso |
| HPV 12 | Beta papillomavirus | Cute | |
| HPV 13 | Alpha papillomavirus | Orale e Genitale | Basso |
| HPV 14 | Beta papillomavirus | Cute | |
| HPV 15 | Beta papillomavirus | Cute | |
| HPV 16 | Alpha papillomavirus | Mucose | Molto alto |
| HPV 17 | Beta papillomavirus | Cute | |
| HPV 18 | Alpha papillomavirus | Mucose | Molto alto |
| HPV 19 | Beta papillomavirus | Cute | |
| HPV 20 | Beta papillomavirus | Cute | |
| HPV 21 | Beta papillomavirus | Cute | |
| HPV 22 | Beta papillomavirus | Cute | |
| HPV 23 | Beta papillomavirus | Cute | |
| HPV 24 | Beta papillomavirus | ||
| HPV 25 | Beta papillomavirus | Cute | |
| HPV 26 | Alpha papillomavirus | Mucose | Possibile |
| HPV 27 | Alpha papillomavirus | Verruche comuni | |
| HPV 28 | Alpha papillomavirus | Cute e Mucose | Basso |
| HPV 29 | Alpha papillomavirus | Cute e Mucose | Basso |
| HPV 30 | Alpha papillomavirus | Mucose | Possibile |
| HPV 31 | Alpha papillomavirus | Mucose | Alto |
| HPV 32 | Alpha papillomavirus | Orale e Genitale | Basso |
| HPV 33 | Alpha papillomavirus | Mucose | Alto |
| HPV 34 | Alpha papillomavirus | Mucose | Alto |
| HPV 35 | Alpha papillomavirus | Mucose | Intermedio |
| HPV 36 | Beta papillomavirus | Cute | |
| HPV 37 | Beta papillomavirus | Cute | |
| HPV 38 | Beta papillomavirus | Cute | |
| HPV 39 | Alpha papillomavirus | Mucose | Alto |
| HPV 40 | Alpha papillomavirus | Cute e Mucose | Alto |
| HPV 41 | Nu papillomavirus | Cute | Possibile |
| HPV 42 | Alpha papillomavirus | Mucose | Basso |
| HPV 43 | Alpha papillomavirus | Cute e Mucose | Basso |
| HPV 44 | Alpha papillomavirus | Condilomi | Basso |
| HPV 45 | Alpha papillomavirus | Mucose | Alto |
| HPV 46 | Sottotipo di HPV 20 | Cute | |
| HPV 47 | Beta papillomavirus | Cute | |
| HPV 48 | Gamma papillomavirus | Cute | |
| HPV 49 | Beta papillomavirus | Cute | |
| HPV 50 | Gamma papillomavirus | Cute | |
| HPV 51 | Alpha papillomavirus | Mucose | Possibile |
| HPV 52 | Alpha papillomavirus | Mucose | Intermedio |
| HPV 53 | Alpha papillomavirus | Mucose | Possibile |
| HPV 54 | Alpha papillomavirus | Mucose | Basso |
| HPV 55 | Sottotipo di HPV 44 | Condilomi | Basso |
| HPV 56 | Alpha papillomavirus | Mucose | Alto |
| HPV 57 | Alpha papillomavirus | Verruche comuni | |
| HPV 58 | Alpha papillomavirus | Mucose | Intermedio |
| HPV 59 | Alpha papillomavirus | Mucose | Alto |
| HPV 60 | Gamma papillomavirus | Cute | Possibile |
| HPV 61 | Alpha papillomavirus | Mucose | Basso |
| HPV 62 | Alpha papillomavirus | Mucose | Basso |
| HPV 63 | Mu papillomavirus | Cute | Verruche |
| HPV 64 | Sottotipo di HPV 34 | Mucose | Alto |
| HPV 65 | Gamma papillomavirus | Cute | |
| HPV 66 | Alpha papillomavirus | Mucose | Possibile |
| HPV 67 | Alpha papillomavirus | Mucose | Alto |
| HPV 68 | Gamma papillomavirus | Mucose | Alto |
| HPV 69 | Alpha papillomavirus | Mucose | Possibile |
| HPV 70 | Alpha papillomavirus | Mucose | Possibile |
| HPV 71 | Alpha papillomavirus | Mucose | Basso |
| HPV 72 | Alpha papillomavirus | Mucose | Basso |
| HPV 73 | Alpha papillomavirus | Mucose | Alto |
| HPV 74 | Alpha papillomavirus | Condilomi | Basso |
| HPV 75 | Beta papillomavirus | Cute | |
| HPV 76 | Beta papillomavirus | Cute | |
| HPV 77 | Alpha papillomavirus | Cute e Mucose | |
| HPV 78 | Alpha papillomavirus | Cute e Mucose | Basso |
| HPV 79 | Alpha papillomavirus | Cute e Mucose | |
| HPV 80 | Beta papillomavirus | Cute | |
| HPV 81 | Alpha papillomavirus | Mucose | Basso |
| HPV 82 | Alpha papillomavirus | Mucose | Alto |
| HPV 83 | Alpha papillomavirus | Mucose | Basso |
| HPV 84 | Alpha papillomavirus | Mucose | Basso |
| HPV 85 | Alpha papillomavirus | Mucose | Alto |
| HPV 86 | Alpha papillomavirus | Mucose | Basso |
| HPV 87 | Alpha papillomavirus | Mucose | Basso |
| HPV 88 | Gamma papillomavirus | Cute | |
| HPV 89 | Alpha papillomavirus | Mucose | Basso |
| HPV 90 | Alpha papillomavirus | Mucose | Basso |
| HPV 91 | Alpha papillomavirus | Cute e Mucose | Basso |
| HPV 92 | Beta papillomavirus | Cute | Possibile |
| HPV 93 | Beta papillomavirus | Cute | |
| HPV 94 | Alpha papillomavirus | Cute e Mucose | Basso |
| HPV 95 | Gamma papillomavirus | Cute | |
| HPV 96 | Beta papillomavirus | Cute | Possibile |
| HPV 97 | Alpha papillomavirus | Mucose | Alto |
| HPV 98 | Beta papillomavirus | Cute e Mucose | Possibile |
| HPV 99 | Beta papillomavirus | Cute e Mucose | Possibile |
| HPV 100 | Beta papillomavirus | Cute e Mucose | Possibile |
