Helicobacter pylori e malattie della pelle
SALERNO
- L’HELICOBACTER PYLORI È STATO ISOLATO APPENA 43 ANNI FA
- L’helicobacter pylori dal greco hělixέλιξ = spirale; βακτήριον = bastoncino; pylōri = piloro (valvola pilorica dello stomaco) è un batterio spiraliforme e gram negativo isolato nel 1982 dalla mucosa gastrica umana in Australia, dal patologo John Robin Warren e dal microbiologo Barry James Marshall, ai quali è stato consegnato il premio Nobel nel 2005, per questa grande scoperta. Nella prima pubblicazione l’helicobacter pilory viene descritto come unidentified curved bacillus. Negli anni successivi è denominato prima Gastric Campylobacter like organism (GCLO), poi nel 1984 Campylobacter pilory e solo nel 1989 al Congresso di Ulm, Helicobacter pylori. Nel 1994, l’International Agency for Research on Cancer classifica l’Helicobacter pylori come cancerogeno di classe I, in quanto associato all’adenocarcinoma gastrico.
INFEZIONE DA HELICOBACTER PYLORI E MALATTIE DELLA PELLE
Alcune patologie dermatologiche, si associano più frequentemente di altre all’infezione da helicobacter pylori. Tra queste ricordiamo la sindrome della bocca urente, il lichen planus, l’eritema nodoso, alcune varianti cliniche di orticaria, la dermatite atopica, la rosacea pustolosa, la psoriasi, l’eczema nummulare, la malattia di Behçet e alcune forme di prurigo. Molte volte, da un fenomeno dermatologico persistente, si scopre poi mediante i test, un’infezione da helicobacter pylori. Alcune patologie dermatologiche associate a infezione da Helicobacter pylori, potrebbero essere collegate all’aumento della produzione di leucotrieni, PAF e istamina in corso di infezione da helicobacter, come tentativo dell’organismo di neutralizzare il batterio. Altre sostanze proinfiammatorie e vasoattive (es. Nα metil istamina) sono prodotte direttamente dall’helicobacter. Alcune patologie dermatologiche, soprattutto se comparse all’improvviso (es. rosacea pustolosa, orticaria, etc), possono essere talora associate a infezione da Helicobacter pylori. Quando la ricerca dell’helicobacter risulta positiva, va iniziata una terapia mirata secondo le attuali linee guida, per eradicare l’infezione. In alcuni casi, il fenomeno dermatologico associato a infezione da Helicobacter pylori, può persistere per periodi più o meno lunghi, anche dopo una corretta eradicazione dell’infezione. In caso di infezione da helicobacter pylori, è consigliabile ricercare il batterio dopo aver completato la terapia (per valutarne il buon esito) e nei conviventi. Pur essendo sensibile alla maggior parte degli antibiotici, si preferisce usare per la sua eradicazione, una terapia combinata, basata sull’associazione di diversi farmaci (es. antibiotici, inibitori della pompa protonica, antistaminici, etc) a causa della scarsa efficacia che avrebbe un singolo farmaco in un ambiente così acido come quello in cui si annida l’helicobacter. Ai farmaci possono talora essere affiancati rimedi naturali (es. N-acetilcisteina, fitoterapici, etc) in grado di coadiuvare l’attività degli antibiotici tradizionali.
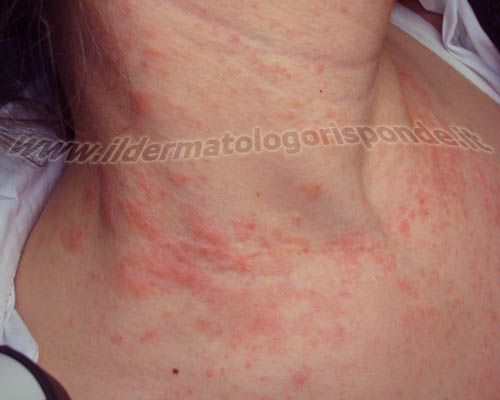
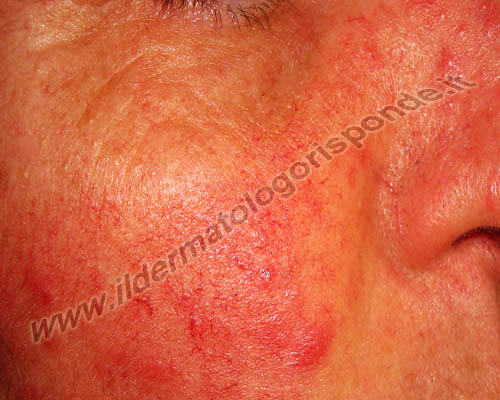
Alcune malattie della pelle, come orticaria (in alto) e rosacea (in basso), possono talora associarsi a un’infezione da helicobacter pylori
HELICOBACTER PYLORI, DISBIOSI INTESTINALE E MALATTIE DERMATOLOGICHE
L’infezione da Helicobacter pylori, può decorrere in maniera del tutto asintomatica e solo raramente può associarsi a fenomeni gastrici (es. gastrite cronica atrofica, ulcera peptica, maltoma, etc) o dermatologici (es. rosacea, orticaria cronica, etc), che ne consentono la ricerca e l’eradicazione mediante una terapia mirata. In condizioni fisiologiche, nello stomaco vi è un ambiente talmente acido da ostacolare la crescita dei batteri. L’helicobacter pylori possiede delle attività enzimatiche (es. ureasi) che consentono di sopravvivere al basso pH dello stomaco ed è in grado di nuotare attraverso il muco gastrico grazie ai suoi flagelli e all’azione mucolitica delle sue proteasi, mucinasi e fosfolipasi. L’helicobacter pylori è in grado di contrastare le normali difese locali, grazie a importanti enzimi come catalasi e superossido dismutasi. La presenza del batterio nella saliva e nelle feci, rende possibile la trasmissione orale, oro fecale e persino (ma non unicamente) per via sessuale. L’helicobacter pylori, di cui esistono diversi ceppi geneticamente diversi, è lungo circa 5 micron e ha un unico cromosoma circolare di circa 1600000 paia di basi, che codifica per circa 1500 proteine. L’enzima ureasi è un dodecamero formato da 6 subunità UreA e 6 subunità UreB e permette di convertire l’urea in ammoniaca e anidride carbonica, innalzando il pH che circonda il batterio e creando negli anni danni alle strutture enzimatiche delle cellule gastriche, fino alla trasformazione neoplastica. L’helicobacter pylori, contiene diverse strutture riconoscibili dal nostro sistema immunitario, tra cui la citotossina vacuolizzante VacA (vacuolizing associated gene A di 270 kDa), la proteina citotossica CagA (circa 130 kDa) e i sistemi di secrezione di tipo 4 (T4SS). Altri fattori di virulenza prodotti dall’helicobacter (es. fosfolipasi, catalasi, superossidodismutasi, xantina ossidasi, elastasi, alcool deidrogenasi, etc) sono collegati con il danno cellulare e la morte della cellula per apoptosi. Il DNA dell’helicobacter pylori, contiene un tratto di appena 40000 paia di basi che codifica per 40 proteine denominato isola di patogenicità (cag-PAI cytotoxin associated pathogenecity island). Prima della scoperta dell’helicobacter pylori, la malattia peptica era definita psicosomatica o associata a stress, oggi è possibile isolare il batterio in oltre il 90% dei casi. L’helicobacter pylori aderisce alla membrana delle cellule gastriche grazie alla produzione di speciali adesine (es. sialic acid binding SabA, N-ANL, GM1, GM2, occludine, claudine, BabA, LeB, etc), attivando una risposta infiammatoria (es. produzione di interleuchina 8, degranulazione degli eosinofili, etc). Esso rimane nel muco gastrico adeso alle cellule epiteliali, senza però invaderle. L’helicobacter pylori sintetizza N-α metilistamina, una sostanza simile all’istamina umana in grado di attivare i recettori istaminergici H2 gastrici e coinvolta nella patogenesi dell’orticaria associata a infezione da Helicobacter. La compromissione della mucosa gastrica determinerebbe un rilascio di altra istamina. L’helicobacter pylori è in grado di sintetizzare anche PAF (platelet activating factor) e di aumentarne la produzione nelle aree gastriche danneggiate. Oltre ad istamina e PAF, nell’infezione da helicobacter pylori, vengono rilasciati anche i leucotrieni (per azione della fosfolipasi A2), sostanze vasoattive coinvolte nel processo infiammatorio di numerose altre patologie (es. orticaria). A livello gastrointestinale, l’helicobacter pylori si comporta come potenziale cofattore ambientale ulcerogeno che in determinate condizioni (es. carica batterica elevata), può far scattare i meccanismi della sorveglianza immunitari e innescare un’infiammazione cronica, predisponendo gli individui alle possibili patologie da essa derivanti. In altre situazioni, si può verificare per alcuni anni una sorta di simbiosi, durante la quale l’organismo può tollerare l’helicobacter pylori, senza fenomeni infiammatori associati. La proliferazione dell’helicobacter pylori a livello gastrico (ambiente con un proprio microbioma, sebbene meno popoloso rispetto a quella intestinale) si può associare a una disbiosi intestinale, che in questi casi potrà essere riequilibrata mediante probiotici, come supporto alla terapia farmacologica classica. L’infezione da helicobacter pylori, interessa oltre la metà della popolazione mondiale e secondo alcuni studi, questo batterio sarebbe un comune germe commensale (simbionte) dello stomaco, che colonizzerebbe solo in secondo momento le aree di flogosi gastrica, rappresentando più la conseguenza dell’infiammazione anziché la causa.
RICERCA DELL’HELICOBACTER PYLORI SULLE FECI O MEDIANTE BREATH TEST
Per la ricerca dell’helicobacter pylori, si può ricorrere a indagini non invasive come il test del respiro (urea breath test) o la ricerca degli antigeni nelle feci (es. test immunoenzimatico) o alla classica gastroscopia con esame istologico. Prima di eseguire la ricerca dell’helicobacter pylori è importante verificare se il paziente ha assunto negli ultimi 15 giorni, antibiotici o inibitori della pompa protonica, in grado di alterare il test. La presenza dell’Helicobacter pylori, induce la sintesi di anticorpi IgG e IgA, che possono essere ricercati attraverso su un comune prelievo di sangue con metodiche come l’ELISA (test immunoenzimatico) e il Western blot. Il problema dei test eseguiti sul prelievo ematico è che forniscono informazioni solo sull’avvenuto contatto con l’helicobacter pylori, senza distinguere tra malattia contratta in passato e infezione ancora in atto. Vi sono anche dei kit rapidi e monouso (es. test monoclonali immunocromatografici) che consentono al paziente di ricercare a casa su un campione di feci gli antigeni dell’helicobacter pylori, in presenza del proprio medico. Il lipopolisaccaride dell’helicobacter pylori stimola i toll-like receptors 4 (TLR-4) e il rilascio di istamina endogena. Inoltre, durante l’infezione da helicobacter pylori, l’attivazione del recettore istaminico H3 da parte di sostanze come la Nα metil istamina (Na-MH), altera la secrezione acida gastrica. Quando il lipopolisaccaride dell’helicobacter pylori induce una risposta infiammatoria, questa non sempre è sufficiente all’eradicazione dell’helicobacter che grazie alle catalasi e alle superossido dismutasi, si protegge dall’azione dei neutrofili e in questo modo, l’infiammazione, da normale meccanismo di difesa, può talora contribuire al danno cellulare. Il lipopolisaccaride dell’helicobacter pylori ha una struttura polisaccaridica simile all’antigene CD15 di Lewis presente sulle cellule umane e questo spiega in parte la tolleranza immunologica di alcuni pazienti (mimetismo molecolare) e dall’altra l’associazione dell’infezione da helicobacter pylori con alcune patologie autoimmuni.
L’HELICOBACTER PYLORI ATTRAVERSO LA STORIA
Nel 1586 il medico italiano Marcello Donati, descrive per la prima volta l’ulcera gastrica. Fino alla fine del XIX secolo si riteneva che lo stomaco fosse un organo completamente sterile e inospitale a qualsiasi forma di agente microbico a causa del suo ambiente particolarmente acido. Nel 1875 i batteriologi tedeschi Georg Bottcher e Michel Letulle notano la presenza di batteri sui margini e nel fondo delle ulcere gastriche, ipotizzando un possibile ruolo eziopatogenetico. Nel 1881, il patologo tedesco Edwin Klebs, riscontra dei microrganismi simili a batteri nelle ghiandole gastriche. Nel 1889 il gastroenterologo polacco Walery Jaworski, isola dei microrganismi spiraliformi (vibrio rugula) e li ritiene collegati alle malattie gastriche. Nel 1892 il medico italiano Giulio Bizzozero osserva dei batteri spiraliformi nello stomaco del cane, classificati nel 1996 come Helicobacter bizzozeroni. Nel 1906 Kreinitz trova delle spirochete nello stomaco di pazienti affetti da carcinoma gastrico. Nel 1924 l’attività enzimatica dell’ureasi gastrica, viene impropriamente attribuita alle cellule dello stomaco, anziché alla presenza dell’helicobacter pylori, fino ad allora ancora sconosciuto. Nel 1939 James Doenges descrive negli USA dei batteri nello stomaco umano, simili a spirochete. Negli stessi anni, ottengono risultati simili diversi ricercatori, tra cui Stone Freedberg e Louis Barron. Nel 1950 uno studio del gastroenterologo americano Eddie Palmer condotto su biopsie provenienti dal corpo gastrico (la maggior parte degli helicobacter è invece presente nell’antro) esclude la possibilità per qualsiasi specie batterica di sopravvivere in un ambiente ostile come lo stomaco e conclude che in questo distretto i batteri si possono riscontrare solo post mortem. Nel 1966 vengono descritti i recettori gastrici per l’istamina. Nel 1968, uno studio americano condotto da Delluva, Markley e Davies, conferma la natura batterica e non umana dell’attività ureasica. L’8 aprile del 1982 il patologo John Robin Warren e il microbiologo Barry James Marshall, isolano l’helicobacter pylori dallo stomaco umano, ricevendo nel 2005 il Premio Nobel per la Medicina. Nel 1997 viene pubblicata la sequenza completa del genoma dell’helicobacter pylori. In uno studio del 2008, viene segnalata la possibile associazione tra vulvodinia e infezione da Helicobacter pylori.
